新冠体外诊断试剂CE认证流程和要求,IVDD欧盟注册办理
采购信息描述及网友解答:
体外诊断试剂/仪器/耗材进入欧盟市场需要进行CE认证,这个CE认证就相当于通行证一样,可以在欧盟成员国进行商业交易。

但目前欧盟正处在从IVDD指令(98/79/EC)到IVDR法规(Regulation (EU) 2017/746)的过渡期,体外诊断试剂/仪器/耗材制造商既可以选择遵照IVDD指令的要求,也可以选择遵照IVDR法规的要求,通过CE认证,合法上市。
距离IVDR CE 的实施时间2022年5月26日的时间已经越来越近。IVDD other欧盟注册还剩30天,即IVDD旧指令下分类为other同时IVDR下分类为class A*、B、C、D的体外诊断试剂,依然可以按IVDD旧指令,完成技术文件和产品注册,注册有效期分别至2025/5/26(D类,如新冠试剂)、2026/5/26(C类)、2027/5/26(B类、A*)。
除了Class A类的产品办理CE可以走欧盟注册,欧代,IVDR技术文件合规路径,B类,C类,D类的CE都是需要公告机构做认证,目前取得IVDR的公告机构只有5家,并且这些公告机构因为人员资格等问题,目前还没准备好接IVDR的案件。
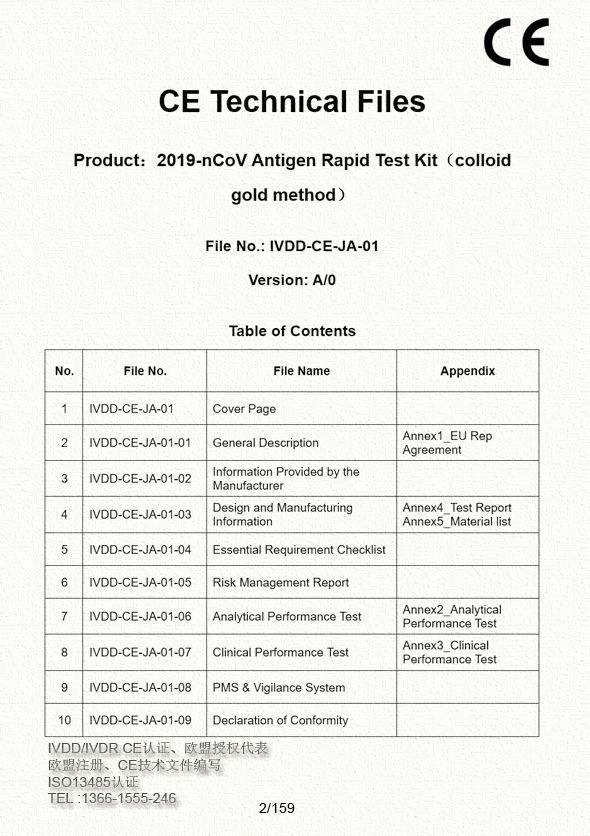
无论是新型冠状病毒抗原检测试剂盒还是新型冠状病毒中和检测试剂盒,亦或是新型冠状病毒核酸检测试剂盒,按照98/79/EC指令的分类规则,用于医护人员测试使用的新冠诊断试剂属于List A和List B之外的IVDD Others产品。其CE合规程序是符合性声明,包括企业准备CE技术文件,签署符合性声明,欧盟授权代表,并由欧盟授权代表完成欧盟成员国主管当局注册。 通过欧盟注册函+DOC符合声明,申请商务部白名单。
关于IVD产品FDASUNGO可供:欧盟授权代表(荷兰、德国)、欧盟注册、IVDD / IVDR CE技术文件编写;ISO13485认证;MDSAP体系辅导;欧盟自由销售证明CFS。
产品风险等级越高,认证流程越复杂,需要参加的机构越多
(NB、欧盟主管当局、欧盟参考实验室、小组)
能够以IVDD Others注册的产品,优先考虑现在直接注册(自我符合性声明):欧盟注册,欧代,CE技术文件(含DOC).
为了制定IVDR下的合规性策略,欧盟委员会建议,制造商应做好差距分析和行动计划,包括以下几个方面:
评估适应新法规给产品带来的影响
核对新的分类规格
确认符合性评估路径
检查和变更已有的技术文件
检查并升级质量管理体系
核对已有临床证据的充分性
风险管理
检查产品说明书、标签
确保上市后监督安排的充分性
准备一份上市后性能跟踪计划
准备应对新的警戒要求
确保溯源义务的实现
[澳洲服务器网图文来源于网络,与本站立场无关,如有侵权,请联系删除]


